Qualitätskontrolle
Wissenschaftler, die sich mit der Qualitätskontrolle (QK) befassen, werden genauestens beobachtet, da sie dafür verantwortlich sind, das Risiko in der Herstellung zu reduzieren, eine schnelle Produktfreigabe zu erreichen und Fehler, Unreinheiten und Verunreinigungen von den Rohstoffen bis hin zum fertigen Produkt zu beseitigen - sowie die relevanten Qualitätssicherungs- (QS) und behördlichen Anforderungen zu erfüllen.
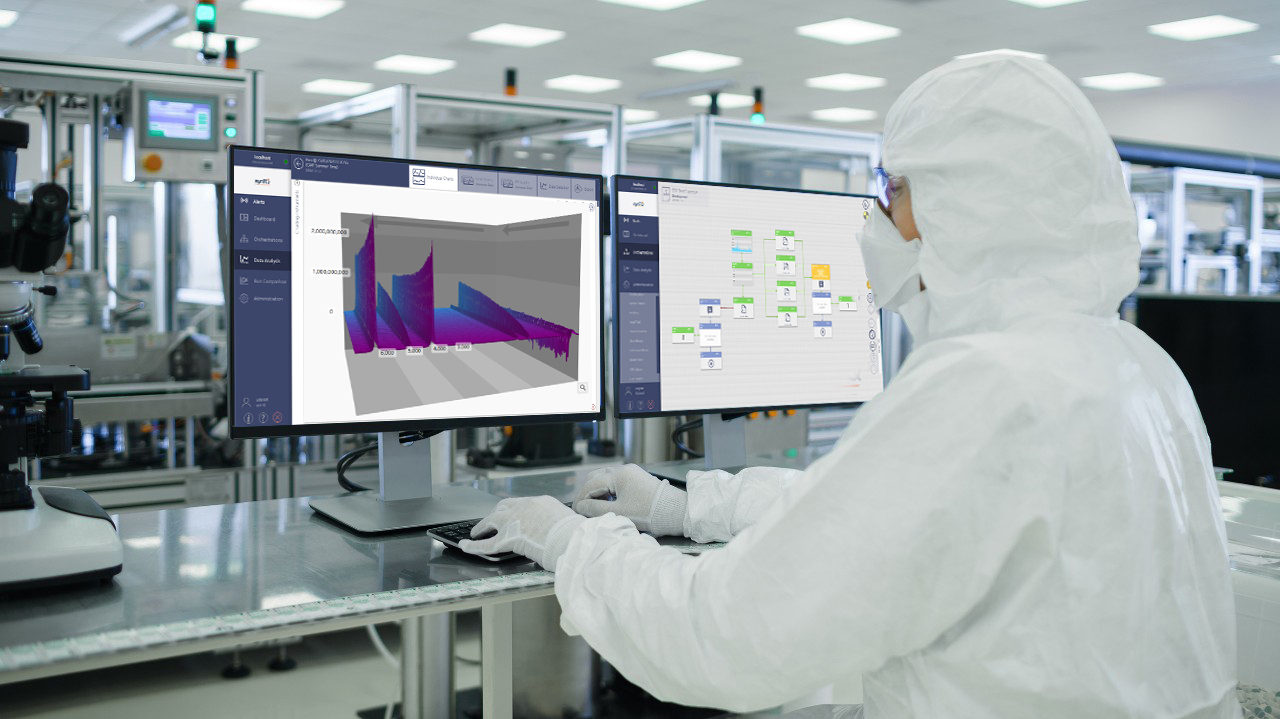
Angesichts immer strengerer Vorschriften für die Pharma- und Biopharmabranche spielen moderne Analysetechnologien eine immer wichtigere Rolle. Sie unterstützen QK-Wissenschaftler bei der Umsetzung und Verbesserung von Prüfstrategien, um sicherzustellen, dass die höchsten Qualitätsstandards erreicht und eingehalten werden. Vor diesem Hintergrund spielen Geräte, die für eine einfache Umsetzung von Standard Operating Instructions (SOP) in einer GMP/GLP/cGMP-Umgebung ausgelegt sind, sowie ggf. die Einbeziehung von Installations- und Betriebsqualifikationsdokumenten (IQ/OQ) und mit 21 CFR Part 11 konformer Software eine wichtige Rolle.
Bruker stellt ein umfassendes Angebot an Analysesystemen zur Verfügung, die den QK-Wissenschaftlern in der Pharmaindustrie dabei helfen, ihr Arbeitspensum zu bewältigen, indem sie Hilfsmittel für QK/QS-Anwendungen bereitstellen, wie z. B.: Mikroanalyse durch FT-IR/Raman-Mikroskopie; Identifizierung von Mikroorganismen durch MALDI-TOF-MS; Bestimmung der Identität und Quantifizierung von Verbindungen durch NMR; Identifizierung von Rohstoffen durch XRD und RFA; Analyse von Fälschungen durch FT-IR; Analyse von APIs, Zusatzstoffen und Verunreinigungen durch LC-MS, NMR und RFA; Kontrolle von Herstellungsprozessen (PAT) durch NMR und RFA.