Contrôle qualité
Les scientifiques du contrôle qualité (QC) sont sous étroite surveillance compte tenu de leur travail pour réduire le risque dans la production, obtenir une sortie rapide du produit et éliminer les défauts, les impuretés et la contamination, des matières brutes au produit final - ainsi que pour supporter une assurance qualité (QA) et des normes réglementaires pertinentes.
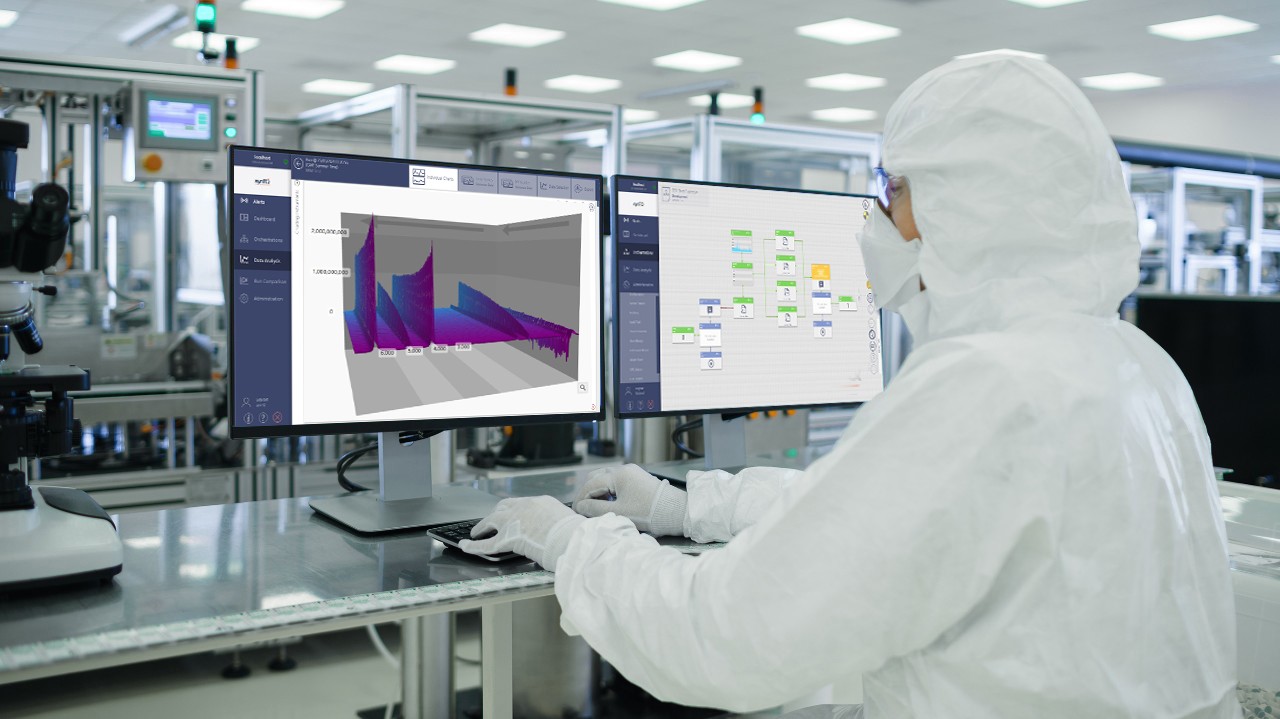
Avec des réglementations de plus en plus strictes s'appliquant à l’industrie pharmaceutique et biopharmaceutique, les technologies analytiques modernes jouent un rôle de plus en plus important, aidant les scientifiques QC à mettre en place et améliorer des stratégies de contrôle pour garantir que les normes qualité maximales soient atteintes et maintenues. Dans ce contexte, les instruments qui sont conçus pour une mise en œuvre simple des procédures d’exploitation normalisées (SOPs) dans un environnement GMP/GLP/cGMP et, autant que faire se peut, l’inclusion des documents de qualification de l’installation et de l’exploitation (IQ/OQ) et d’un logiciel conforme à 21 CFR partie 11 joue un rôle important.
Bruker fournit une vaste gamme de systèmes analytiques, aidant les scientifiques QC pharmaceutiques à gérer leur charge de travail en fournissant des outils pour des applications QC/QA comprenant : microanalyse par la microscopie IRTF/Raman ; identification microbienne par MALDI-TOF-MS ; détermination de l'identité des composants et analyse quantitative par RMN ; identification des matières brutes par XRD et XRF ; analyse contrefaite par IRTF ; analyse des API, additifs et impuretés par LC-MS, RMN et XRF ; contrôle du processus de fabrication (PAT) par RMN et XRF.