肿瘤学
无创成像推动了解肿瘤发展、对治疗的反应和药物毒性的关键见解
临床前研究助力癌症治疗的新发现
“一刀切”的方法不适合于癌症治疗,因为肿瘤有许多不同的类型,还有一些肿瘤我们知之甚少。先进的成像技术可以帮助我们研究肿瘤发展的机制和治疗的效果。
近年来,癌症治疗有了巨大的进步,然而,仍然有一些肿瘤类型是我们知之甚少的,它们对现有的治疗方法没有最佳的回应。此外,还有许多病例无法治愈或产生了严重的副作用。因此,我们仍要研究发现新的癌症治疗方法,并开发出针对当前治疗方法的更佳的方案。肿瘤成像技术在这种研究工作中一直发挥着关键作用。
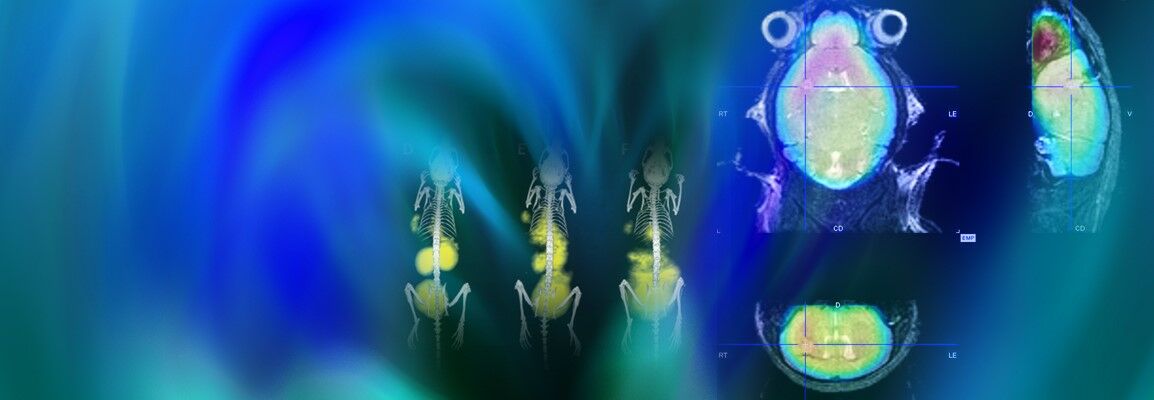
无创性成像可以对肿瘤发展、治疗反应和药物毒性提供关键见解。通过结合结构和功能成像模式,可以进一步提高单个成像策略的分析价值。在临床前研究中使用活体成像的多模式成像,可以以高灵敏度和分辨率实时观察与癌症有关的过程。通过使用各种成像技术,包括MRI、SPECT、PET和CT以及micro-CT,人们对一系列肿瘤有了更深入的了解并改进了治疗方案。
布鲁克提供全方位的创新型无创活体成像技术,以促进对肿瘤进展过程、机制以及治疗效果的了解。双模式成像配置,如PET/CT和PET/MR,甚至是结合了PET、SPECT和CT技术的三模式仪器,可以满足当今最具挑战性的研究需求,并提供放射性物质、骨骼和软组织的定量三维断层图像。